多发性骨髓瘤(MM)是一种浆细胞(PC)恶性肿瘤,通常以一种良性病症开始,称为意义不明的单克隆性丙种球蛋白病(MGUS),并可随着时间推移过渡到明显的浆细胞白血病和髓外骨髓瘤。该病的特征包括血钙浓度升高、肾衰、贫血、免疫功能受损和溶骨性骨病变。多发性骨髓瘤约占所有癌症的1%,占所有血液学恶性肿瘤的10%。个人有 MGUS 病史则是发展为MM的一个公认的风险因素,每年转化为MM的风险为1%。
为了解MM 的生物学和临床方面而进行的日益全面的研究工作,促进了新的方案、药物和治疗方法的发展,从而显著提高了完全缓解(CR)率。因此,需要有更好的策略来检测和定义低水平的疾病,并预测长期结果。治疗期间未被根除的残留肿瘤性 PC(也称为可测量的残留病,MRD)的数量可能比例很低,从而不容易被形态学或其它常规技术发现。为了更好地对患者进行分层,已经开发了分子和流式细胞检测 MRD 的方法,检测灵敏度为0.001%-0.0001%。
MM患者MRD评估的临床意义早有报道,多参数流式细胞术(MFC)MRD 阴性已被公认为预测长期良好结果的有力指标。MFC被证明具有更高的适用性(适用于>95%的患者)、更广泛的可用性、更简单的仪器设置、更短的报告时间(<6 小时)、更好的可重复性,并允许定量评估抗原表达水平以进行表型分析。
为了可靠地应用流式方法来评估极低含量的骨髓瘤细胞,方法开发需要考虑以下多种因素来保证检测准确性和检测灵敏度:
a.骨髓采集量
b. 治疗后 MRD 评估的最佳时间点
c. 疾病的局灶性
d. 骨髓样本的运输和储存条件
e. 用于识别正常与异常 PC 的抗体克隆选择
f. 既往用过抗体药物的免疫疗法
g. 骨髓细胞前处理方法
h. 获取数百万事件的方案条件优化
i. 数据分析和结果解读策略
在这里,我们重点讨论标本采集、样品处理、方案设计、抗体克隆的选择、质量控制和建立 LOD 和 LLOQ 的方法。
PART 1
· 样品储存和质量·
由于PC通常存在于骨髓中,骨髓是用于评估MM MRD的主要标本来源。外周血也被认为是评估 PC 疾病的合适标本,尽管它在 MM MRD 中的作用还有待确定。一般认为,与其他细胞学方法相比,流式细胞术会低估骨髓中PC的比例。Rawstron 等人在他们的研究中证实了这一观点,他们还明确指出,第一次抽吸的样本中PC的浓度最高,以后每次抽吸都会明显下降。虽然通过MFC 检测对明显复发的MM MRD 样本的临床解释不可能因为血液稀释而改变,但对于含有极低比例异常浆细胞的 MRD+样本,这种稀释可能会引起假阴性。因为高度代表性的骨髓标本对于有效和精确的结果至关重要,为了避免由于过度的外周血稀释造成的采样偏差,第一次抽吸的骨髓应始终用于MRD 评估。
遗憾的是,第一次抽出的骨髓经常留给形态学或其他病理学检查,因此,流式细胞室往往只能得到次优标本。Ó skarsson JÞ 等人研究出了一种名为骨髓质量指数(BMQI)的新方法来评估骨髓标本采样质量,通过比较第一次和第二次抽取的骨髓,他们发现有核红细胞和髓系前体细胞最能预测稀释程度。与第二次相比,首次采样的标本中这些细胞的比例更高。
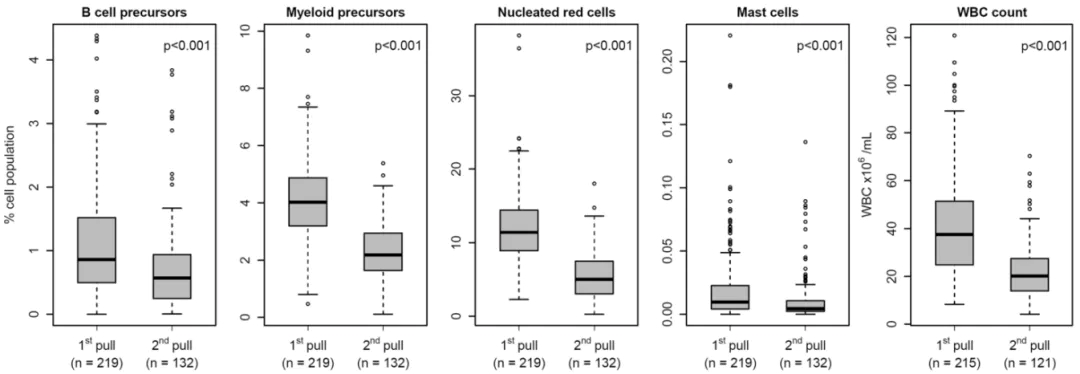
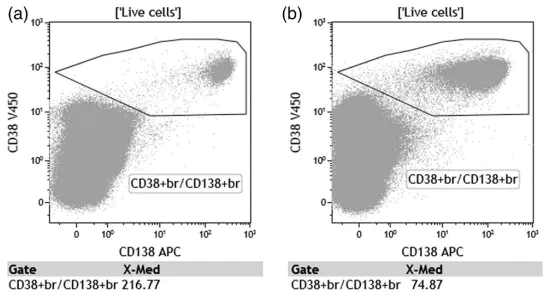
需要注意的是,吸出的骨髓细胞可以用 EDTA 或肝素钠真空管收集,但由于储存在肝素中时 CD138 信号会减弱,所以 EDTA 比肝素钠更受欢迎。ACD 不得用于骨髓标本抗凝,因为标本与抗凝剂的比例不是最佳的,会改变PH 值,从而降低细胞的存活率。新抽出的骨髓标本可以补充少量的完全培养基,并应在室温下储存不超过 48 小时。如果标本在较低温度下储存较长时间,CD138 抗原可能会脱落,CD138 强度及变异系数会大幅增加(如下图)。骨髓在运输和储存过程中应严格避免温度过度变化,但室温运输已被证实是可以接受的。由于标本年龄是 MFC 分析中的一个关键变量,因此应在标本上标注采集日期和时间并尽快处理。多中⼼临床试验采用的标准是从标本采集到染色不超过 24 小时。
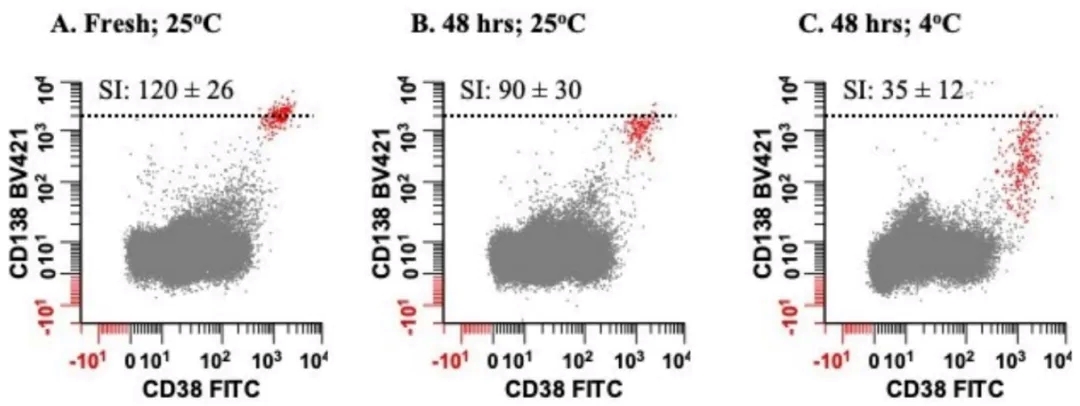
此外,标本质量受损的证据包括溶血、凝块、骨髓稀释、标本摸起来太冷或太热,以及存在凋亡的浆细胞(在分析过程中检测到前向散射和侧向散射光减少)。应评估骨髓细胞活率,如果低于 85%,则被认为是 MM MRD 检测的次优选择。只要样本的完整性受到影响,就必须在最后的报告中注明观察结果。
PART 2
· 方案和克隆选择 ·
由于在治疗后的骨髓穿刺物中可能存在极少量异常 PC,而且患者细胞浓度基本已经恢复至正常水平,采集到足够的细胞数量显得难能可贵,ICCS(国际临床流式协会)推荐使用一管十色方案精确评估 MM MRD,不仅大大节约了样本,还避免多管重复设门造成技术成本上升。目前的共识建议使用CD38 和 CD138 设门圈选 PC,通过表面单克隆抗体 CD19、CD56、CD27、CD81、CD117 以及胞质抗 Kappa 和抗 Lambda 多克隆等抗体来精确区分正常和异常 PC。

开发或修改目前实验室的 MM MRD 方案,都应该完成方法确认才能进行病人结果报告。适当验证每个标记物结合荧光素的分辨能力,确定抗体性能的方法是将其染色分辨率与方案中使用的所有其他抗体一起评估,而不是单独使用该抗体,最好是通过染色指数的计算来实现。除了评估所使用的荧光单抗的染色指数外,还要优化方案设计,避免选择的荧光染料有显著的扩散误差从而导致相关通道的分辨率下降。
需要注意的是,随着针对 MM 细胞表面抗原(如 CD38 单抗等)新药相继被用于临床,这些疗法可以阻断 MM 细胞表面抗原达数月之久,因此可能对多色流式检测产生干扰。Darzalex® (daratumumab)是一种抗 CD38 IgG1kappa 人单克隆抗体,以高亲和力与独特的 CD38 表位结合,已被证明是治疗难治性多发性骨髓瘤患者的有效药物。daratumumab 使更多患者获得 MRD阴性并提高了生存率。由于 CD38 是用于多色流式识别 PC 的关键标识物,因此 daratumumab 的使用会影响 MM MRD 的检测灵敏度。更不幸的是,另一个主要设门标识 CD138 可以在 PC 上异质性表达,并在不正确的储存条件和/或细胞老化时从细胞表面脱落。
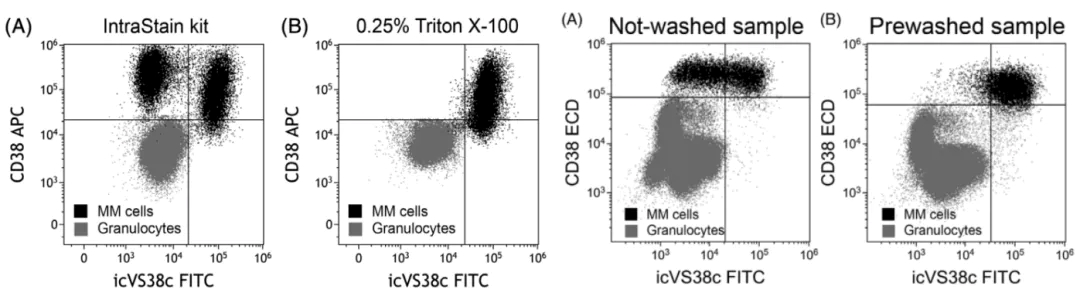
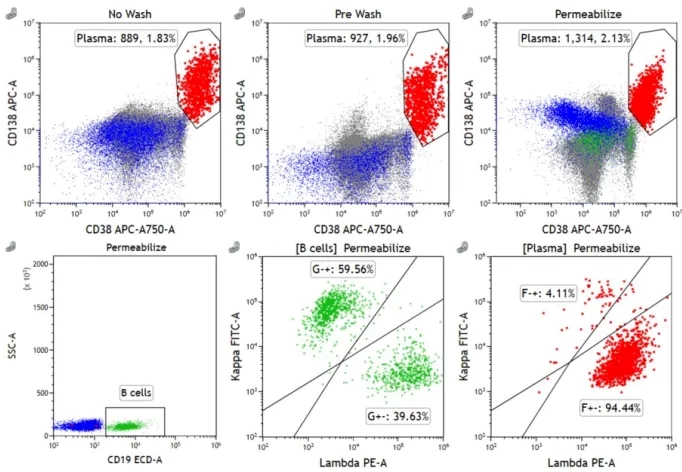
目前,当 CD38 和/或 CD138 受到影响时,可以考虑替代标识,例如:大多数 PC 表达的 CD54、CD229 和 CD319。然而,这些标记不是 PC 特异性的,所以限制了它们完全取代 CD38 和/或 CD138 来检测 PC 的可能性;CD269 的表达更具 PC 特异性,但并非所有 PC 都表达此特定标记;EuroFlow 建议使用多表位的CD38-ME 抗体。然而,CD38-ME 抗体在 daratumumab 存在的情况下仅能部分恢复 CD38 的检测,并且强度仍然减弱,与未经处理的样品相比,荧光强度损失超过 50%;VS38c 是一种能识别内质网 CLIMP-63 蛋白的小鼠mAb,使用 VS38c 是基于假设肿瘤性 PC 由于分泌能力增强,故以远高于正常PC 和其他白细胞亚群的水平表达 CLIMP-63。但有研究已经表明,虽然 VS38c在大多数 PC 中高度表达,但它也由其他造血细胞表达,包括单核细胞、髓系细胞和 B 细胞亚群。另外,VS38c 需要破膜检测,对破膜剂要求较高,细胞不进行预洗涤也会影响结果(如下图)。选择 Perfix-NC 使用一步法对 PC 进行固定破膜和染色,可以有效减少处理步骤繁琐导致自发荧光增加,而且大大缩减了样本制备时间。
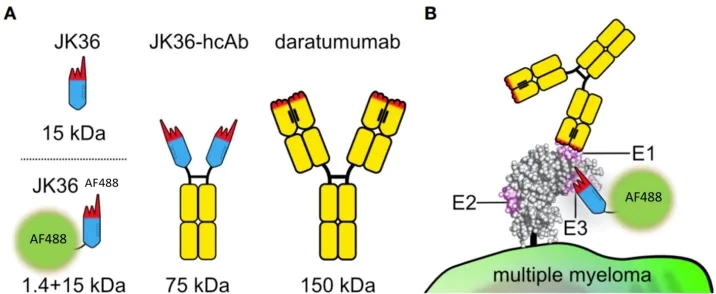
目前能够克服这些克隆的弊端的一种策略是使用 CD38 纳米抗体(CD38nano,克隆 JK36)对 PC 进行染色,纳米抗体是单可变结构域抗体片段(VHH),通常会暴露较长的互补决定区 3(CDR3),该特性使抗 CD38nano 能够识别抗 CD38 疗法无法掩盖的隐秘表位。
PART 3
· 样品处理方法 ·
目前的共识建议是每管至少采集 2×10E6 个细胞,最好是 5×10E6 个细胞,还建议使用“预裂解”的染色程序来获得 MRD 评估所需的大量细胞,同时承认其他染色程序经过适当验证后也可使用。
在“预裂解”程序中,大量骨髓样品在染色之前先用大体积裂解液裂解,接着染色标记,在上机之前,再次裂解以去除残留的红细胞。但习惯了“染色后裂解”的实验室使用该方法可能比较难转换过来。此外,两次裂解可能会影响某些抗原的染色强度(如下图),或导致某些串联染料的分解。
另一种替代方法是使用“混合管”方法。这种方法是将骨髓样本按照常规程序(先染色后裂解)处理后,最后混在一起增加可获取的细胞总数。使用“混合管”方法的优点是和实验室常规操作步骤一致,更容易接纳。此外,该方法只裂解一次,故可更好地保留抗原表达。
另外,自动化的流式样本制备可以标准化,提升效率和结果准确性,也是一种值得推荐的方法。流式样本制备允许一次性移液 400uL 骨髓样本进行抗体染色,支持“预裂解”和“染色后裂解”等方法,并可以机载完成细胞预洗涤、溶血后洗涤和固定破膜等程序。利用流式样本制备进行MM MRD 样本制备,结果表明:相较于免洗方法检测骨髓 PC,细胞得率并没有受到样本预洗涤和破膜等流程的影响,且 PC 比例没有明显变化(如下图)。
无论如何都不能使用 Ficoll 富集细胞,因为富集过程会导致 PC 的选择性丢失并影响一些抗原表达(例如 CD138)。
PART 4
· 检测限和定量下限 ·
在大多数临床实验室中,MFC 识别骨髓中肿瘤性 PC 的检测灵敏度范围为 10E-4(万分之一)到 10E-6(百万分之一)。尽管多中心数据已证明 0.01%的最低检测灵敏度对 MRD 评估具有明确的预后价值,但很明显,随着检测灵敏度的提高,MRD 状态与临床结果之间的相关性也在增加。
为了建立测定和/或仪器的检测灵敏度以从背景中枚举少量真实 PC,需要建立空白限(LOB)、检测限(LOD)和定量下限(LLOQ)。
LOB 被定义为在没有浆细胞的样本中,MRD 最终设门区域能检测到的背景事件数量或百分比,因为已知大多数骨髓至少含有一定水平的浆细胞,所以使用骨髓样本染上 MM MRD 方案中所有的抗体(除了 CD38 和 CD138 以外),就能完成 LOB 的建立。
LOD 则被定义为可靠地区分高于 LOB 水平的浆细胞的能力,在此水平,99%以上的具有低水平 PC 的样品将被检测出来,其计算方法是 LOB 平均值加上 3 倍 LOB 测量值的标准偏差。
LLOQ 被定义为在某些预定义的偏倚和不精密度下,可以在LOB以上可重复检测到的PC的最低数量或百分比。临床普遍认为MRD检测的不精密度(变异系数)不应超过30%。
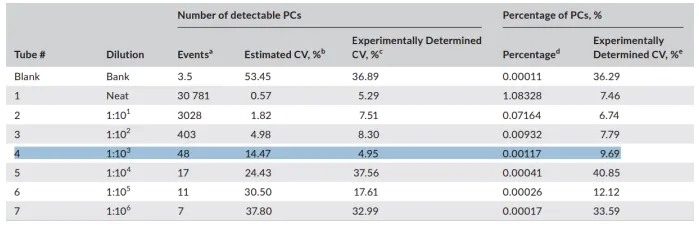
其他研究表明,20 个事件是 LOD 理论上的保守阈值。共识指南建议 MMMRD 的 LOD 至少为 0.001%,这意味着最少收集 2×10E6 个事件进行分析。如果采集的细胞数量少于 200 万且未检测到 MRD,则应对 LOD 进行说明,并在报告中说明分析灵敏度降低的限定性声明。同样,通常使用 50 个事件来表示LLOQ 阈值,因此,总事件数为 5×10E6 才能达到 0.001%的 LLOQ。尽管如此,根据美国病理学家学会的建议,每个实验室都应凭经验确认其 LOD 和 LLOQ。LLOQ 的最佳确定方法是,使用接近 LOD 的至少三种不同浓度样品重复 3-5 次对异常 PC 进行计数。确定 LLOQ 的一种实用方法是将患有浆细胞疾病的骨髓样本按照 MM MRD 方案进行全染色,用部分染色的健康样本进行连续倍比稀释,得到低浓度样本。
PART 5
· 数据分析和报告 ·
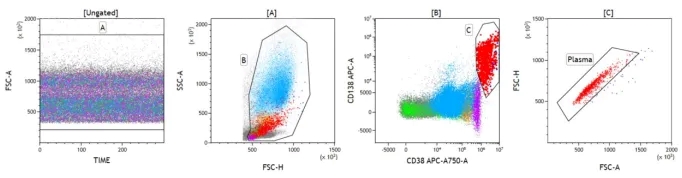
MRD 数据的分析在很大程度上取决于分析人员定义正常与异常 PC 的专业知识水平。作为标准做法,理想的数据分析工作流程应从 Time 参数开始,以排除无效事件,例如气泡或堵塞。FSC-A、W、H 的组合用于排除粘连体。但是,在评估 PC 时应格外小心,因为它们的 FSC 和 SSC 可能很难固定,不同患者之间可能相差很大。Sidana 及其同事在一项前瞻性研究中表明,根据流式细胞术评估,275 名新诊断的 MM 患者中有 17 名(6%)是四倍体,这些四倍体群体通常表现出高于正常细胞群体的异常光散射特征,由于其较高的散射光信号,这些细胞很可能落入散点图的“粘连体”区域。出于这个原因,当使用前向和侧向散射光信号来排除粘连体时,应注意不要排除这个群体。圈出总浆细胞的完整设门策略见下图:
如果浆细胞表达异常抗原或者表现出正常抗原的表达水平增加或减少,则通常认为浆细胞是异常的。目前的共识是用 CD38、CD138、CD45 和光散射特征的组合识别 PC,为了准确区分骨髓瘤细胞与正常 PC,方案中应包括CD38、CD45、CD19、CD56、CD81、CD117 和胞内轻链。正常 PC 通常表达为 CD38bright、CD45+、CD19+、CD56−、CD27bright、CD81bright 和 CD117−且无轻链限制性。异常 PC 通常会有 2 个或更多标识的异常表达。例如,肿瘤PC 出现 CD38 减弱和 CD45 缺失,CD19-、CD56+/bright、CD27dim、CD81dim 和轻链限制性表达可用于识别异常 PC。
当前挑战
由于流式 MM MRD 检测已成为确定新疗法疗效和患者反应深度的重要方法,因此需要一种共识方法,以便可以解释独立实验室之间的测试结果可重复性和意义。2013 年对美国实验室进行骨髓瘤流式 MRD 的一项调查表明,流式细胞术数据分析缺乏标准化方法导致 MM MRD 分析和解释存在重大差异。从那时起,一系列努力使这些方面标准化,例如,英国国家外部质量评估服务中心(UK NEQAS)最近倡导了一个外部质量评估计划,该计划评估了流式细胞术检测 MM MRD 的可重复性。在这项研究中,将含有 0%、0.1%、0.01%、0.001%和 0.0001%的5个稀释系列的骨髓样本分发给 10 个国际实验室,其中 8 个实验室提交了答复。这些实验室被要求使用他们自己实验室建立的程序对细胞进行染色,并根据 MM MRD 测试的样本染色、采集、分析和报告的共识指南对骨髓瘤细胞进行定量评估。总体而言,该研究证明了低至0.001%的 MRD 水平还存在良好的检测线性,8个实验室中有6个检测到肿瘤PC 的最低限水平为0.0001%。然而,在方案设计、荧光染料偶联物和使用的裂解试剂中发现了偏差。该研究得出的结论是,如果MFC对MM MRD的评估进一步标准化,也可以减少实验室间的差异。
● 引用文献:
1. Soh KT, Wallace PK. Evaluation of measurable residual disease in multiple myeloma bymultiparametric flow cytometry: Current paradigm, guidelines, and future applications. Int JLab Hematol. 2021 Jul;43 Suppl 1:43-53. doi: 10.1111/ijlh.13562. PMID: 34288449.
2. Stetler-Stevenson M, Paiva B, Stoolman L, Lin P, Jorgensen JL, Orfao A, Van Dongen J andRawstron AC. Consensus Guidelines for Myeloma Minimal Residual Disease Sample Stainingand Data Acquisition. Cytometry Part B 2016; 90B: 26–30.
3. Czeti A, Szaloki G, Varga G, Szita VR,Komlosi ZI, Takács F, et al. Limitations of VS38c labelingin the detection of plasma cell myeloma by flow cytometry. Cytometry. 2022;101:159–66.
4. Annemiek Broijl, Augustinus C M de Jong, Mark van Duin, Pieter Sonneveld, JesperKühnau, Vincent H J van der Velden, VS38c and CD38-Multiepitope AntibodiesProvide Highly Comparable Minimal Residual Disease Data in Patients With MultipleMyeloma, American Journal of Clinical Pathology, Volume 157, Issue 4, April 2022,Pages 494–497.
5. P859: ANTI-CD38 NANOBODY JK36 ALLOWS RELIABLE MRD DETECTION INDARATUMUMAB TREATED MULTIPLE MYELOMA PATIENTS
